STRUKTUR ATOM DAN SISTEM PERIODIK
Perkembangan
model atom
1 Model Atom Dalton
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
- Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom- atom yang identik dan berbeda untuk unsur yang berbeda.
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atas atom-atom hidrogen dan atom-atom oksigen.
- Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
2 Model
Atom Thomson
Atom adalah bola padat bermuatan positif dan di
permukaannya tersebar elektron yang bermuatan negatif.
3 Model
Atom Rutherford
Atom
adalah bola berongga yang tersusun
dari inti atom dan elektron yang
mengelilinginya. Inti atom bermuatan positif dan massa atom terpusat
pada inti atom.
Struktur
atom Bohr dan mekanika kuantum.
1
Model Atom Niels Bohr
- Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah lintasan ke lintasan yang lebih tinggi, elektron akan menyerap energi. Jika beralih ke lintasan yang lebih rendah, elektron akan memancarkan energi.
- Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu yang disebut kulit-kulit elektron.
2 Model Atom Modern.
Kulit-kulit
elektron bukan kedudukan yang pasti dari suatu elektron, tetapi hanyalah suatu
kebolehjadian saja.
Nomor atom dan nomor massa
Atom
adalah bagian terkecil dari suatu unsur yang masih memiliki sifat unsur
tersebut. Struktur atom menggambarkan bagaimana partikel-partikel dalam atom
tersusun. Atom tersusun atas inti atom dan
dikelilingi elektron-elektron yang tersebar dalam kulit-kulitnya. Secara sistematis dapat
digambarkan partikel-partikel subatom sebagai berikut.
jumlah proton dalam inti
atom menentukan muatan inti atom,
sedangkan massa inti ditentukan oleh banyaknya proton dan neutron.
Selanjutnya ketiga partikel subatom (proton, neutron, dan elektron) dengan
kombinasi tertentu membentuk atom suatu unsur yang lambangnya dapat
dituliskan:
A X Z
X
: lambang suatu unsur
Z : nomor atom
A
: nomor massa
Nomor
Massa (A) = Jumlah proton + Jumlah neutron
Atau
Jumlah
Neutron = Nomor massa – Nomor atom
Nomor Atom
(Z) = Jumlah proton
Konfigurasi
elektron dan
Diagram orbital
Konfigurasi
Elektron
Konfigurasi
(susunan) elektron suatu atom berdasarkan kulit-kulit atom tersebut. Setiap kulit atom
dapat terisi elektron maksimum 2n2, di mana n merupakan letak kulit.
Jika n = 1 maka berisi 2
elektron
Jika n = 2 maka berisi 8
elektron
Jika n = 3 maka berisi 18
elektron
dan seterusnya.
Lambang kulit dimulai dari K, L,
M, N, dan seterusnya dimulai dari yang terdekat dengan inti atom.
Elektron
disusun sedemikian rupa pada masing-masing kulit dan diisi maksimum sesuai daya tampung
kulit tersebut. Jika masih ada sisa elektron yang tidak dapat ditampung pada kulit tersebut maka diletakkan pada
kulit selanjutnya.
(a)
Tingkat-tingkat energi subkulit elektron
periode ke-1 sampai ke-7
(b)
Cara distribusi elektron pada subkulit
Urutan subkulit dari energi terendah
sampai tertinggi yaitu sebagai berikut. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d,
5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 6f, 7d
Bilangan kuantum dan
bentuk orbital
1.Bilangan Kuantum dan Bentuk Orbital
Pada
teori atom mekanika kuantum, untuk menggambarkan posisi elektron digunakan
bilangan-bilangan kuantum. Daerah kemungkinan elektron berada disebut orbital. Orbital
memiliki bentuk yang berbeda-beda. Untuk memahami bilangan kuantum dan
bentuk-bentuk orbital perhatikan uraian berikut.
2.Bilangan Kuantum
Schrodinger
menggunakan tiga bilangan kuantum yaitu bilangan kuantum utama (n), bilangan
kuantum azimut (l), dan bilangan kuantum magnetik (m). Ketiga bilangan kuantum tersebut menjelaskan
tingkat energi, bentuk, dan orientasi elektron di dalam orbital. Selain
ketiga bilangan kuantum tersebut ada bilangan kuantum spin (s) yang
menunjukkan perputaran elektron pada sumbunya.
a.Bilangan
Kuantum Utama
Bilangan kuantum utama memiliki lambang
n. Harga n melambangkan tingkat energi elektron atau
kulit elektron. Harga n untuk berbagai kulit elektron yaitu sebagai
berikut.
Elektron pada kulit ke-1, memiliki harga
n = 1.
Elektron pada kulit ke-2, memiliki harga
n = 2.
Elektron pada kulit ke-3, memiliki harga
n = 3.
Elektron
pada kulit ke-4, memiliki harga n = 4.
b. Bilangan Kuantum Azimut
Bilangan kuantum azimut memiliki
lambang l. Bilangan kuantum azimut menyatakan tingkat energi elektron
pada subkulit. Subkulit elektron mempunyai lambang s, p, d, f. Huruf-huruf
tersebut berasal dari kata sharp (s), principal (p), diffuse (d), dan fundamental (f) yang diambil dari nama-nama seri spektrum unsur.
Harga l untuk
berbagai subkulit yaitu sebagai berikut. Elektron pada subkulit s
memiliki harga l = 0 Elektron pada subkulit p memiliki harga l =
1 Elektron pada subkulit d memiliki harga l = 2 Elektron pada subkulit f
memiliki harga l = 3
Hubungan harga n dengan l adalah harga l mulai
dari 0 sampai dengan n-1.
C. Bilangan Kuantum Magnetik
Bilangan kuantum
magnetik memiliki lambang m yang
menunjukkan arah orbital elektron. Bilangan kuantum magnetik menyatakan jumlah
orbital pada subkulit elektron. Bilangan kuantum ini bernilai negatif, nol, dan
positif. Secara matematika harga m dapat
ditulis mulai dari -l sampai dengan +l. Harga m untuk
berbagai l atau subkulit
Baca Juga MAKALAH PROSES PELEBURAN BAJA
Golongan
dan periode
Hubungan
Konfigurasi Elektron dengan Letak Unsur pada Tabel Periodik
Nomor
kulit dan jumlah elektron yang ada pada subkulit menunjukkan letak unsur pada tabel periodik. Jadi ada hubungan
antara konfigurasi elektron dengan letak
unsur pada tabel periodik. Hubungan konfigurasi elektron dengan letak unsur
pada tabel periodik untuk golongan utama dan golongan transisi berbeda.
Perhatikan uraian berikut.
1.Hubungan Konfigurasi Elektron dengan Letak Unsur pada
Tabel Periodik untuk
Golongan Utama
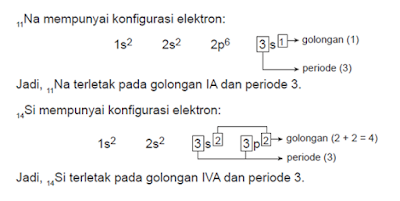
ditentukan dari jumlah
elektron pada kulit terluar. Nomor periode ditentukan dari nomor kulit Letak unsur pada tabel periodik dapat ditentukan
dengan mengetahui nomor golongan dan
nomor periode. Nomor golongan dan nomor periode dapat ditentukan dari
konfigurasi elektron. Nomor golongan terbesar.
Contoh
2.Hubungan
Konfigurasi Elektron dengan Letak Unsur pada Tabel Periodik untuk Golongan
Transisi
Cara
menentukan letak unsur pada tabel periodik berdasarkan konfigurasi elektron untuk unsur transisi berbeda dengan unsur
golongan utama. Perhatikan konfigurasi elektron golongan unsur transisi
periode ke-4
Nomor golongan unsur transisi ditentukan dari jumlah
elektron 3d dengan 4s. Untuk
golongan IIIB, IVB, VB, VIB, VIIB, dan VIIIB, nomor golongan diambil dari
jumlah elektron pada subkulit 3d dan 4s.
Golongan IB dan IIB diambil dari jumlah elektron pada subkulit 4s.
Nomor periode tetap diambil dari nomor kulit (bilangan
kuantum utama) terbesar. Pada unsur transisi
ada tiga kolom yang diberi nomor golongan yang sama yaitu golongan
VIIIB.
Sifat keperiodikan unsure
Ø
Jari-Jari
AtomJari-jari
atom adalah jarak dari inti atom sampai kulit elektron terluar.
a.
Dalam satu golongan
dari atas ke bawah jari-jari atom semakin besar.
b.
Dalam satu periode dari
kiri ke kanan, jari-jari atom semakin kecil.
Ø
Energi
Ion isasi
Energi ionisasi adalah energi minimum
yang diperlukan untuk melepaskan elektron dari suatu atom netral dalam wujud
gas. Energi yang diperlukan untuk melepaskan
elektron kedua disebut energi ionisasi kedua dan seterusnya. Bila tidak ada keterangan khusus maka yang disebut
energi ionisasi adalah energi ionisasi pertama.
Dapat
disimpulkan keperiodikan energi ionisasi sebagai berikut.
a.
Dalam satu golongan
dari atas ke bawah energi ionisasi semakin berkurang.
b.
Dalam
satu periode dari kiri ke kanan energi ionisasi cenderung bertambah.
Ø Afinitas Elektron
Afinitas elektron
adalah besarnya energi yang dibebaskan satu atom netral dalam wujud gas pada
waktu menerima satu elektron sehingga terbentuk ion negatif.
a.
Dalam
satu golongan dari atas ke bawah afinitas elektron semakin kecil.
b.
Dalam
satu periode dari kiri ke kanan afinitas elektron semakin besar.
Ø Keelektronegatifan
Aalah suatu bilangan yang
menyatakan kecenderungan suatu unsur menarik elektron dalam suatu molekul
senyawa.
a.
Dalam satu golongan
dari atas ke bawah keelektronegatifan semakin berkurang.
b.
Dalam satu periode dari
kiri ke kanan keelektronegatifan semakin bertambah.
Isotop, isobar, isoton
1.
Isotop
Isotop adalah atom yang mempunyai nomor atom sama
tetapimemiliki
nomor massa berbeda.
2.
Isobar
Isobar
adalah unsur-unsur yang memiliki nomor atom berbeda tetapi nomor massa sama.
Sehingga antara 136C dan 137N
merupakan isobar.
3.
Isoton
Atom-atom yang berbeda tetapi mempunyai jumlah neutron
yang sama.









Belum ada Komentar untuk "STRUKTUR ATOM DAN SISTEM PERIODIK"
Posting Komentar